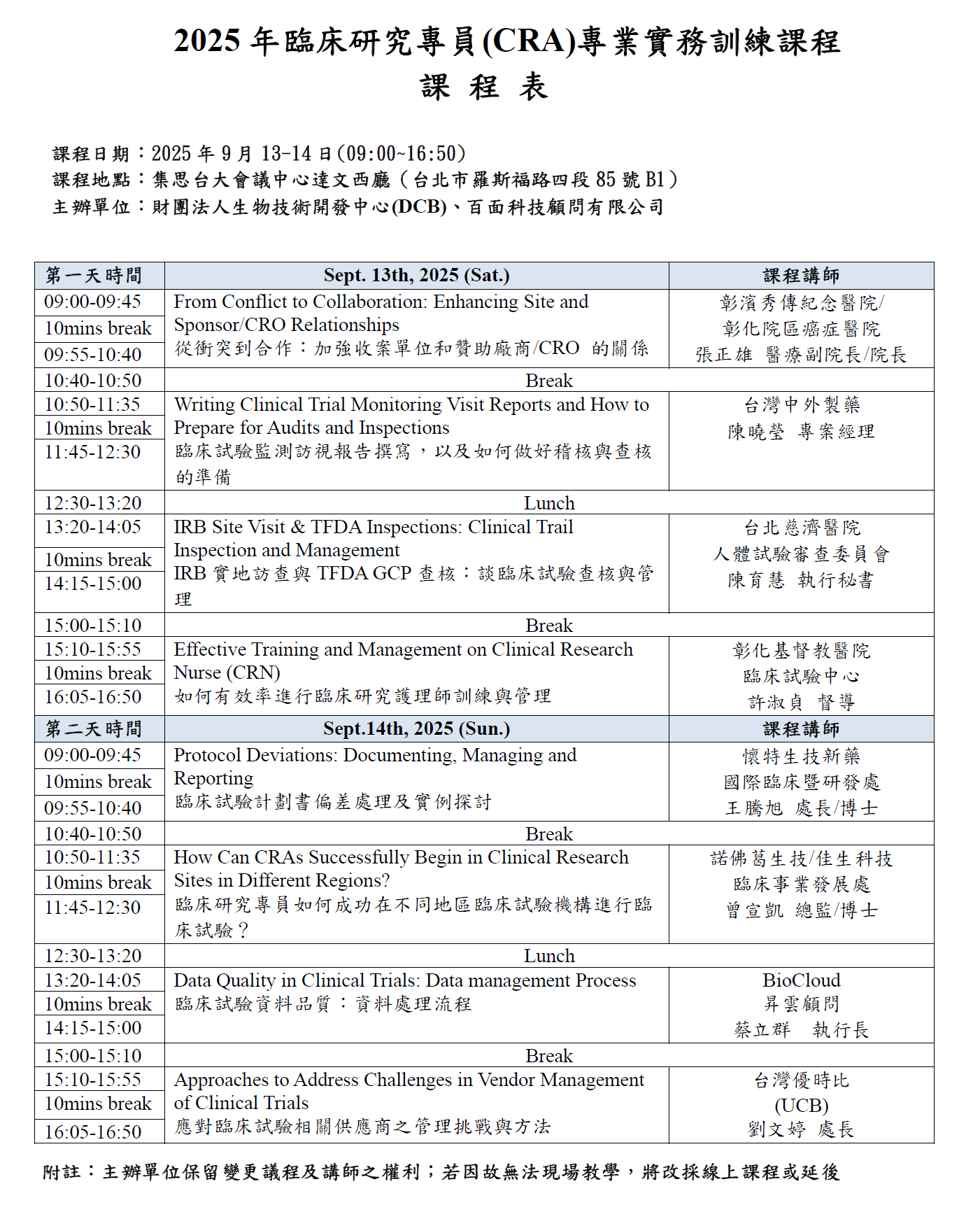
2025年臨床研究專員
(Clinical Research Associate, CRA)
專業實務訓練課程
課程說明: 新藥臨床試驗當前已成世界性顯學!世界各國政策均強調臨床研究研發以因應險峻局
勢,我國卓越臨床試驗研發質量卓越,亦獲世界各國稱許;健保署籌設新台幣100億元新藥
基金,更為臨床試驗產業注入強心針,其中人員訓練即為其中重要環節。
臨床研究專員(CRA)薪資在各行業排名中名列前茅,五大產業創新研發計畫中亦包含積
極推動生物科技產業政策,現今國內外藥廠、CRO、醫材廠商、生技公司等相關產業對CRA
人才需求孔急,為相關學經歷背景者提供最佳職涯發揮平台。
本課程為台灣極寶貴之專業實務訓練課程,以Global Reach, Local Expertise為課
程設計目標,提供無經驗或初任或資深CRA之學員提供全方位藥品、醫材、食品臨床研究
及CRA角色功能指導。內容可提供生技產業新職涯選擇之整備,藉助豐富經驗的實務講師
提供逐步指導、獨到的工作手冊等寶貴資訊可供立即運用於CRA工作或謀職利器。
課程涵蓋CRA工作必備職能,遵循ICH GCP法規架構,師資成員延聘自醫療機構院長、
總監顧問、著名藥廠、CRO及醫學中心卓具實務經驗高階主管。提供有意加入CRA 工作卻不
知如何切入者或機構彌補專業訓練缺口、學界欲轉業界者及年資2年內亟盼業務精
進者均提供難得的學習機會!小班式教學,名額有限,請有志者把握難得的機會報名,全
程參與者生技中心(DCB)將提供學員精美上課證書並贈送CRA工作手冊,課程證明可供臨床
試驗執行及送審法規所需12小時GCP必要學分時數,獲致專業職能提升,加強面談自信。
二天課程期間現場同步另邀博士級資深顧問,免費提供就業及專業領域諮詢協助。
課程特色:
- 醫療機構及業界專家面對面實體互動授課
- 國際同步職場實例講解及實踐問題解決導向學習活動
- 提供實務工作運用為基礎內容,協助學員工作場域之工具
- 提供專業課程時數證明,符合國內法規需求
課程目標:
1. 資深試驗主持人經驗分享及精闢分析如何加強收案單位和贊助廠商/CRO 的關係
2. 徹底指導臨床試驗監測訪視報告撰寫,以及如何做好稽核與查核的準備,創造共贏
3. 多年實務分享IRB實地訪查與TFDA GCP查核案例與管理
4. 由試驗機構主管指引如何有效率進行臨床研究護理師訓練與管理
5. 工具指導CRA各階段新藥開發與臨床試驗設計精隨,通盤瞭解計畫書內容重點及偏差處理
6. 經驗分享成功在不同地區臨床試驗機構進行跨國性臨床試驗
7. 以DM角度剖析臨床試驗資料品質,指引資料處理正確流程
8. 國內罕見應對臨床試驗相關供應商之管理挑戰與方法實務課程講授
建議學員:1. 任職生技業CRA之 In-house或Field-based CRA欲再精進者
2. 目前任職臨床研究相關產業(CRO、生技公司、藥廠、醫材廠商、精準醫療、醫院、研
究機構等),想要嘗試或瞭解不同角色職責者
3. 其他尚無經驗,未來有意進入藥品、醫材、食研、醫研臨床試驗工作領域之醫藥相關
人士及應屆畢業學生,需要謀職之專業知識技能者
4.缺乏臨床試驗GCP時數者或生醫及臨床試驗領域相關機構提供員工在職訓練需求者
課程日期: 2025年9月13-14日(09:00~16:50)
課程地點:集思台大會議中心達文西廳(台北市羅斯福路四段85號B1)
主辦單位:財團法人生物技術開發中心(DCB)、百面科技顧問有限公司
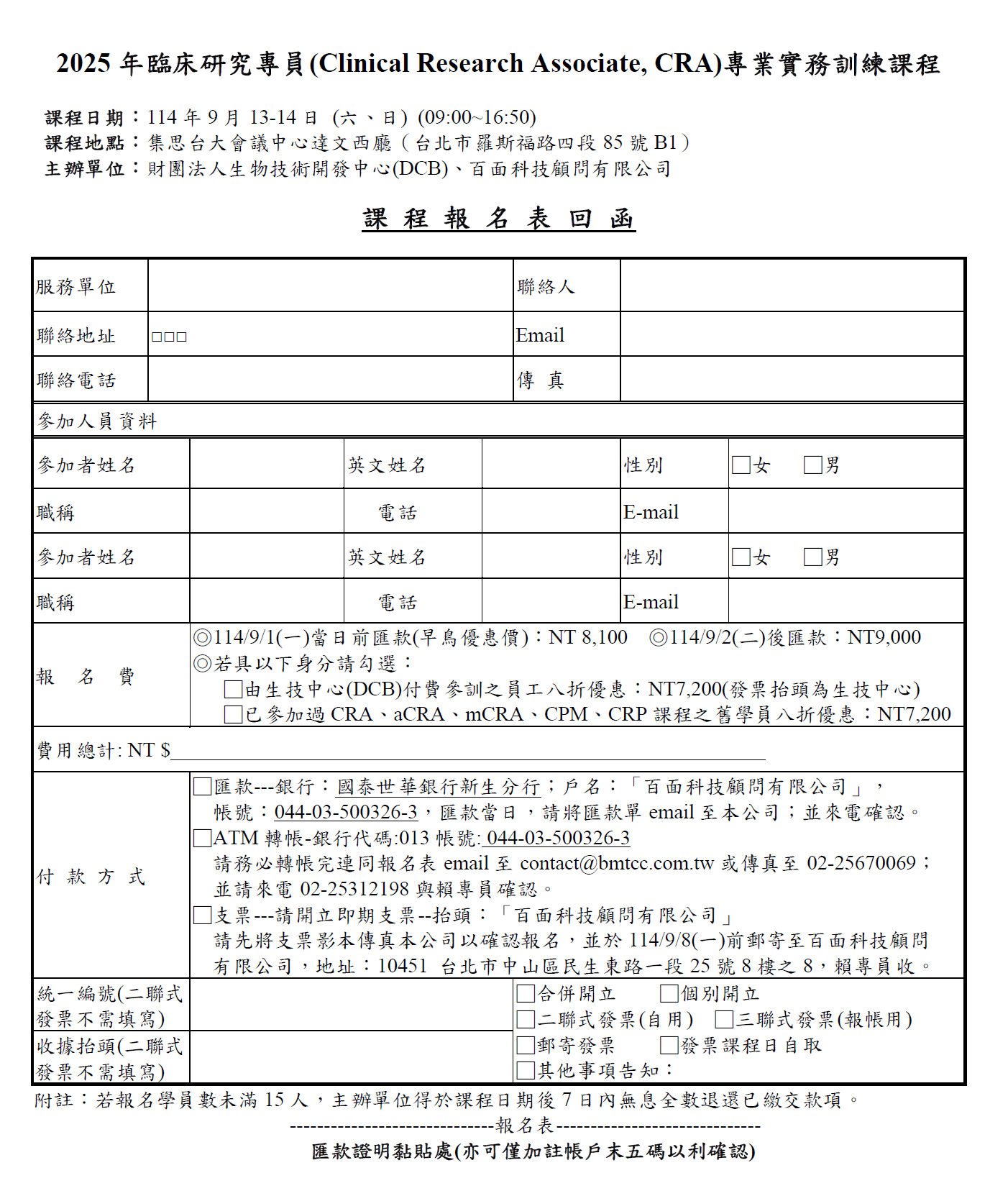
報名時間:座位有限,額滿為止,最遲請於114/9/8(一)前完成繳費,將以繳費順序保留座位權利
報 名 連 結: 點我下載報名表
報名方式:e-mail、傳真或電話報名,Tel:02-2531-2198,Fax:02-2567-0069,
e-mail:
報 名 費: ◎114/9/1 (一)當日前匯款(早鳥優惠價): NT 8,100
◎114/9/2 (二)後匯款: NT9,000
◎生技中心(DCB)付費參訓之員工八折優惠: NT7,200
◎已參加過CRA、mCRA、CPM、CRP課程之舊學員八折優惠: NT 7,200
(以上均含講義、CRA工作手冊、精美中英文證書、早餐、中餐及茶點,小班教學名額
有限,已完成繳費者為優先順序,恕無提供停車優惠)
繳費方式:1.匯款或ATM轉帳--銀行:國泰世華銀行新生分行,銀行代碼:013
戶名:「百面科技顧問有限公司」,轉帳帳號:044-03-500326-3
2.支票:10451 台北市中山區民生東路一段25號8樓之8,賴專員收
注意事項:請於完成繳費後,將匯款單或轉帳收據連同報名表列印email或傳真至百面科技公司;
寄送支票者,也請先將支票影本及報名表列印後傳真至百面科技公司,並請來電確認
聯絡人員:賴專員 聯絡電話:02-2531-2198 傳真:02-2567-0069 電郵:
講師簡介:
張正雄:彰濱秀傳紀念醫院醫療副院長、彰化院區癌症醫院院長,曾任彰基醫療副院長,內科部長、
血液腫瘤科及臨床試驗中心主任,IRB主任委員。具美國ACRP之臨床試驗主持醫師(CPI)
認證並獲聘專業講師,主持國內外多項臨床試驗專案,為國際知名之臨床試驗主持醫師,
中國醫藥大學醫學士
陳曉瑩:台灣中外製藥股份有限公司專案經理,曾任專案副理及資深臨床研究專員,實際參與多件國
際性臨床試驗(Phase I - III,包含 First in Patient),以及Sponsor audit與TFDA inspection,
具有多年試驗案執行、監測管理之經驗,高醫大藥理學碩士
陳育慧:台北慈濟醫院人體試驗審查委員會執行秘書,臨床研究受試者保護中心兼任秘書,東吳大
學科技法律研究所碩士,精熟IRB送件流程及審查重點,IRB staff職責及工作效率要求,
累積15年以上臨床試驗案審查實務及問題解決方式
許淑貞:任職醫學中心彰化基督教醫院臨床試驗中心督導,具美國ACRP臨床專業 CCRC證照,
實際執行領導多件國際性臨床試驗,對臨床試驗專案執行、CRN管理訓練及業務均有豐富
經驗及心得
王騰旭:現任懷特生技新藥國際臨床暨研發處處長,曾任職佳生科技顧問公司醫學科學部經理、嬌
生公司楊森藥廠醫藥學術部門、新加坡i3 research CRO、國防醫學院,以及台灣東洋、東
生華等藥廠臨床研究部門。Tim取得台大農化系生物工業化學組碩士及博士學位
曾宣凱:諾佛葛生技/佳生科技臨床事業發展處總監,台北醫學大學藥學博士,曾任佳生科技國際及
區域業務總監、徐州佳生醫藥科技總經理、臨床總監,具跨國性臨床試驗計畫豐富實務經驗
蔡立群:BioCloud昇雲顧問執行長,曾任PAREXEL Manager, Dept. of Data Management Lead (DML),
A+ Inc Director, Division of Biometrics and Data Management,PPC Manager, Division of
Biometrics and Data Management,累積多年國際臨床試驗案成功管理經驗,國立中央大學統
計學碩士
劉文婷:台灣優時比 (UCB)處長,曾任三顧生醫事業群副總經理、嬌生公司生物研究質量和合規部經
理,百靈佳殷格翰臨床試驗品質管理經理、CDE GCP查核小組長、資深專案經理、GSK
臨床試驗經理、美商惠氏藥品台灣區臨床試驗經理、MSD臨床試驗品質管控經理,高雄醫
學大學藥學士
 繁體中文
繁體中文  日本語
日本語  English
English 



